Informatii generale Monomerii de fibrina (MF)
Monomerii de fibrină (MF) reflectă activitatea trombinei, prezenta lor având semnificație predictivă pozitivă precoce în comparație cu alți markeri hemostatici pentru apariția evenimentelor trombotice1.
Hemostaza este un proces fiziologic complex ce are rolul de a opri sângerarea prin formarea cheagului de fibrină la nivelul epiteliului vascular lezat. Răspunsul hemostatic este rapid, localizat și bine reglat. Hemostaza presupune trei etape ce se succed rapid: vasoconstricția, generarea dopului plachetar (hemostază primară) și activarea procesului de coagulare (hemostază secundară), ceea ce duce la formarea cheagului de fibrină. Această fibrină insolubilă formează o rețea în jurul dopului plachetar pentru a consolida și stabiliza cheagul1.
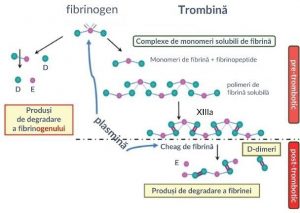
Trombina, protează importantă în cascada coagularii, scindează fibrinopeptidele A și B prin activitate proteolitică asupra domeniului N- terminal al lanțurilor α și β de la nivelul fibrinogenului, rezultând monomerii de fibrină (MF). În funcție de cantitatea generată și de factorii locali, monomerii de fibrină pot forma complexe solubile, necovalente, cu fibrinogenul și cu diverse produse de degradare a fibrinogenului/fibrinei. Aceste complexe sunt numite complexe ne-covalente de monomeri de fibrină solubilă (CMSF). În etapele finale, aceste complexe polimerizează, sub acțiunea factorului XIIIa (FXIIIa) și formează un tromb ([Fig. 1])1,2.
MF pot fi considerați un marker pre- trombotic
D-Dimerii sunt rezultatul fibrinolizei în etapa post-trombotică
Deoarece concentrația MF reflectă activitatea trombinei, iar nivelurile lor pot fi detectate mai devreme decât D-Dimerii, MF pot fi utilizati ca o alternativă pentru evaluarea trombozei.
Sub denumirea de monomeri de fibrină (MF) sunt cuprinse urmatoarele molecule ce nu pot fi distinse separat: monomeri de fibrină solubilă (MFS), fibrina solubilă (FS), complexe de monomeri de fibrină (CMF), complexe de monomeri solubili de fibrina (CMSF)1.
Recomandări pentru efectuarea Testului monomerilor de fibrină – TMF
Evaluarea statusului de hiper-coagulabilitate:
- Coagularea intravasculară diseminată (CID) este o tulburare trombohemoragică sistemică asociată cu hiperactivarea coagulării și a fibrinolizei secundare. Se caracterizează prin insuficiență de organe, ca urmare a trombozei microvasculare, și sângerare, rezultată din consumul de trombocite și factori de coagulare ( factorii II, V si X ). 1,2,3
Deoarece nu există un test de laborator specific pentru a confirma diagnosticul de CID, Societatea Internațională de Tromboză și Hemostază (ISTH) propune un sistem de punctare pentru diagnosticul de CID. Componentele sistemului de punctare includ scăderea numărului de trombocite, prelungirea timpului de protrombină (PT), creșterea markerilor de producere sau degradare a fibrinei (fibrin-related markers) și scăderea fibrininogenului.
Markerii de producere sau degradare a fibrinei (fibrin-related marker) includ D-dimerii (DD), produșii de degradare ai fibrinei (FDP) și monomerii de fibrină (MF).
Algoritmul de diagnostic CID bazat pe testele de laborator include urmatorii parametrii:1,4,5
Numărul de trombocite:
- > 100,000/µl (0 puncte )
- 50,000 – 100,000/µl (1 punct)
- < 50,000/µl (2 puncte)
Creșterea markerilor de producere sau degradare a fibrinei (fibrin-related markers):
- valori negative (0 puncte)
- creștere moderată (2 puncte)
- creștere marcată (valori de 5 ori mai mari față de limita superioară a intervalului de normalitate) (3 puncte)
Timpul de protrombină (secunde)
- creștere ≤ 3 secunde față de limita superioară a normalului (0 puncte)
- creștere între 3 – 6 secunde față de limita superioara a normalului (1 punct)
- creștere ≥ 6 secunde față de limita superioara a normalului (2 puncte) Un scor de 5 sau mai mare este înalt sugestiv pentru diagnostic CID în evoluție. Un scor <5 este sugestiv pentru risc de
- Trombembolismul venos (tromboză venoasă profundă, trombembolism pulmonar) Utilizarea atât a D-Dimerilor cât și MF pentru excluderea DVT este superioară utilizării doar a D- Dimerilor. MF pot fi un marker util la pacienții la care se suspecteză o embolie pulmonară1.
- Afectiuni maligne: Statusul dehiper-coagulabilitate prezent la pacienții cu neoplasme se asociază cu un nivel crescut de MF. MF pot fi asociați atât cu creșterea tumorii cât și cu creșterea aderenței plachetelor la celulele tumorale contribuind astfel la apariția metastazelor. La pacienții cu carcinom renal metastatic MF pot fi utilizați pentru evaluarea răspunsului la chimioterapie1.
- Accidente vasculare cerebrale: creșterile MF indică starea de hiper-coagulabile din timpul accidentului vascular cerebral ischemic; cu toate acestea, MF nu au utilitate în detectarea timpurie a AVC- urilor1.
- La pacienții cu fibrilația atrială, evaluarea hemostazei nu intră în practica uzuală. Există rezultate controversate privind utilitatea testării monomerilor de fibrina la acești pacienți1.
- În IMA (infarct miocardic acut), MF au valoare predictivă pentru dezvoltarea timpurie a trombului coronarian în primele 24 de ore de IMA. Prezența MF la pacienții cu dureri precordiale pot permite diagnosticarea precoce a 1
- În sarcină, evaluarea extensivă a coagulării/markerilor fibrinolitici, se face în cazul în care pacientele au antecedente de tromboză venoasă profundă, embolism pulmonar sau trombofilie. În general, markerii de coagulare și de fibrinoliză sunt crescuți pe parcursul sarcinii normale. Testarea MF ar putea fi utilă pentru a evalua hiper-coagulabilitatea în cazul sarcinilor cu risc ridicat de tromboză1.
- Evaluarea riscului de tromboză la pacienții chirurgicali presupune testarea atât a MF, cât și a D-Dimerilor1.
Pregătire pacient
à jeun sau post-prandial. În cazul tratamentul cu heparină se recomandă ca recoltarea sa fie facută după 4 ore de la ultima administrare de heparină nefracționată.
Specimen recoltat – sânge venos.
Recipient de recoltare – vacutainer cu citrat de Na 0.105 M (1/9),capac bleu/verde2.
Cantitatea recoltată – cât permite vacuumul 2.
Cauze de respingere a probei:
- specimen hemolizat
- specimen coagulat
- vacutainer care nu este plin
- specimen care nu a sosit la laborator în maxim 8 ore de la recoltare.
Prelucrare necesară după recoltare
Se separă plasma prin centrifugare, de preferat în prima oră de la recoltare, pentru a obține o plasmă saraca in trombocite şi se lucrează cât mai repede. Dacă acest lucru nu este posibil, plasma se poate stoca la -20°C2.
Stabilitate probă (plasmă separată): 8 ore la 18-25°C; 1 lună la -20C (de preferat). Se va evita decongelarea/recongelarea2.
Metodă – latex-aglutinare automata cu detectie fotometrica (test cantitativ)2.
Valori de referinţă Testul monomerilor de fibrină – TMF
< 6 μg/mL2.
Limita de detecție – 5 μg/mL2.
Interpretarea rezultatelor
Pentru diagnosticul CID, rezultatul se va interpreta în contextul sistemului de punctare propus de ISTH.
Limite și interferențe
Prezenta factorului reumatoid poate interfera cu determinarea MF si produce rezultate fals pozitive3.
Tratamentul cu heparină nefracționată în doze > 1 UI/ml sau cu heparină cu greutate moleculară mică (LMWH) în doze mai mari de 2 anti-Xa IU/ml pot interfera cu determinarea MF.
Bibliografie
- Refaai, Paul Riley, Tatsiana Mardovina, Phoenix D. Bell- The Clinical Significance of Fibrin Monomers In Thromb Haemost 2018; 118(11): 1856-1866 DOI: 10.1055/s-0038- 1673684
- Laborator Synevo. Referinţe specifice tehnologiei de lucru utilizate 2019. Ref Type: Catalog
- Kyoung-Jin Park, M.D., Eui-Hoon Kwon, M.T., […], and Sun-Hee Kim, M.D. Evaluation of the Diagnostic Performance of Fibrin Monomer in Disseminated Intravascular Coagulation in Korean J Lab Med. 2011 Jul; 31(3): 143–147
- Asakura H, Takahashi H, Uchiyama T, et al. Proposal for new diagnostic criteria for DIC from the Japanese Society on Thrombosis and Hemostasis. Thromb J. 2016; 14:42. Published 2016 Sep 28. doi:10.1186/s12959-016-0117-x 1)
- Medscape- Disseminated Intravascular Coagulation Workup https://emedicine.medscape.com/article/199627-workup#c7
- Mackie, I. J., Kitchen, S, Machin, S. J., Lowe, G. D. and (2003), Guidelines on fibrinogen assays. British Journal of Haematology, 121: 396-404. doi:1046/j.1365- 2141.2003.04256.x


